Thông báo: Bệnh viện Da liễu Trung ương mời các nhà thầu quan tâm nộp hồ sơ chào giá đăng ký thực hiện dự toán mua sắm Bộ kít tách chiết
.
Báo giá- Mời thầu- 1 giờ trước
Sáng: 7h30-12h00
Chiều: 13h30-16h30
Sáng: 6h00-7h30
Sáng: 7h30-12h00
Chiều: 14h-17h30
1. ĐẠI CƯƠNG
– Omalizumab là kháng thể đơn dòng tái tổ hợp gắn đặc hiệu với IgE tự do trong huyết thanh và ngăn cản IgE tương tác với thụ thể của nó trên các tế bào bạch cầu ái kiềm và tế bào mast từ đó ngăn chặn sự giải phóng hạt từ tế bào mast và ngăn chặn hoạt động của các chất trung gian gây dị ứng khác góp phần vào bệnh cảnh mày đay mạn tính tự phát [1][2].
– Omalizumab đã được FDA chấp thuận ở người từ 12 tuổi trở lên cho điều trị [1][3][12]:
+ Hen dai dẳng mức độ trung bình đến nặng không đáp ứng đầy đủ với corticosteroid đường hít
+ Mày đay mạn tính tự phát (CSU) không đáp ứng với điều trị kháng histamin H1
+ Kể từ năm 2003, omalizumab đã được chấp thuận điều trị thêm cho bệnh nhân hen dưới 6 tuổi và đã được nghiên cứu vai trò trong nhiều tình trạng dị ứng và tăng bạch cầu ái toan khác.
2. DƯỢC LÝ HỌC
* Cấu trúc
– Là một kháng thể đơn dòng IgG1k trọng lượng phân tử 149 kDa, nguồn gốc >95% từ người, <5% từ chuột [1][13].
– Trong môi trường in vitro, omalizumab gắn với IgE tự do tạo nên phân tử lớn nhất là vòng 6 phân tử: gồm 3 phân tử omalizumab và 3 phân tử IgE. Phức hợp tương tự đã được tìm thấy ở khỉ [14].
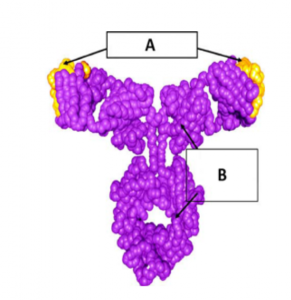
Hình 1. Cấu trúc omalizumab. A: Phần nguồn gốc từ chuột (<5%). B: Phần nguồn gốc từ người (>95%)
* Dược động học
– Dược động học tuân theo mô hình hấp thu bậc 1 và trở nên tuyến tính khi liều lớn hơn 0.5mg/kg. Với bệnh nhân mày đay mạn tính tự phát, hấp thu tuyến tính xảy ra với liều đơn độc từ 75-600mg. Sử dụng omalizumab 4 tuần một lần dẫn đến tăng theo tỷ lệ thuận nồng độ đáy huyết thanh (nồng độ thấp nhất của thuốc) theo kiểu phụ thuộc liều (đối với liều 75–300mg) [1].
– Sinh khả dụng khi tiêm dưới da của omalizumab là 62%
– Nồng độ đỉnh đạt được sau tiêm liều đầu tiên 1 tuần
– Thể tích phân bố là 78±32 ml/kg ở bệnh nhân hen (tương tự bệnh nhân CSU)[1]
– Nghiên cứu trên khi cho thấy không có mô hay cơ quan nào hấp thu (bắt) omalizumab khi dùng đường tĩnh mạch
– Thanh thải omalizumab gồm 2 phần:
+ Thanh thải omalizumab tự do: tương tự như IgG nội sinh thông qua gan, sau đó là hệ thống lưới nội mô (hay thường được gọi là hệ thống thực bào đơn nhân). Một phần omalizumab cũng được thải qua mật[1]
+ Thanh thải phức hợp omalizumab-IgE: thông qua quá trình nhập bào và nhanh hơn thanh thải IgG tự do[1]
Độ thanh thải của omalizumab ở bệnh nhân CSU là 240ml/ngày.
Thời gian bán thải của omalizumab xấp xỉ 24 ngày.
Omalizumab không cần chỉnh liều theo cân nặng, lứa tuổi và nồng độ IgE huyết thanh (toàn phần hay tự do) ở bệnh nhân CSU [1].
3. CƠ CHẾ TÁC DỤNG
Omalizumab gắn chọn lọc với IgE tự do với ái lực cao tại vùng Cε3 trên chuỗi nặng, tại vị trí gắn kết với thụ thể IgE. Dẫn đến ngăn cản IgE tương tác với thụ thể của nó (FcεRI) trên bạch cầu ái kiềm và tế bào mast. Bằng cách ức chế sự tương tác này, omalizumab ngăn chặn sự giải phóng histamine và các chất trung gian gây dị ứng khác. Lưu ý, omalizumab không liên kết với IgE đã cố định trên bề mặt tế bào hoặc với các thụ thể IgE bề mặt tế bào, và do đó, không dẫn đến sự mất hạt bạch cầu ái kiềm hoặc hoạt hóa tế bào mast. Tác dụng của omalizumab không thể giải thích đầy đủ chỉ với cơ chế hình thành phức hợp miễn dịch với IgE tự do. Một vài cơ chế hoạt động của omalizumab trong CSU đã được đề xuất[2][13][15][16].
Các cơ chế đã được thống nhất và hiểu rõ nhất cho omalizumab trong CSU gồm:
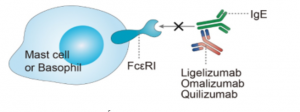
Hình 2. Cơ chế tác dụng của omalizumab
4. ỨNG DỤNG LÂM SÀNG
– Bệnh nhân ≥ 6 tuổi với hen dai dẳng mức độ trung bình đến nặng kèm:
+ Test da dương tính hoặc phản ứng với một dị nguyên trong không khí quanh năm
+ Không kiểm soát đầy đủ bằng corticosteroid đường hít
Ở những bệnh nhân này, omalizumab đã chứng minh là giảm cả triệu chứng hen và giảm cả nhu cầu dùng thuốc[1][21]. Ở bệnh nhân hen, cân nặng của bệnh nhân và nồng độ IgE huyết thanh sẽ quyết định liều và tần suất sử dụng omalizumab. Lưu ý rằng đối với ngưỡng IgE trên ngưỡng phụ thuộc cân nặng thì không nên chỉnh liều omalizumab.
– Bệnh nhân ≥ 12 tuổi với mày đay mạn tính tự phát (CSU) không đáp ứng với điều trị kháng histamin H1
Không giống như hen, liều omalizumab ở bệnh nhân CSU không phụ thuộc vào cân nặng của bệnh nhân và nồng độ IgE huyết thanh. Các tài liệu còn chưa thống nhất về việc liệu nồng độ IgE huyết thanh có hữu ích trong việc dự đoán đáp ứng lâm sàng với omalizumab hay không. Các nghiên cứu hồi cứu về omalizumab trong CSU của Metz và cộng sự[22] và Viswanathan và cộng sự[23] không tìm thấy mối liên quan giữa nồng độ IgE huyết thanh và đáp ứng lâm sàng với omalizumab. Một nghiên cứu hồi cứu thứ ba của Straesser và cộng sự[24] cho thấy nồng độ IgE thấp hơn có liên quan đến đáp ứng lâm sàng thấp hơn đáng kể với omalizumab. Omalizumab hiện không được FDA chấp thuận để điều trị bất kỳ thể mày đay nào khác.
– Viêm da cơ địa
Hiệu quả của omalizumab ở bệnh nhân viêm da cơ địa là một chủ đề còn nhiều tranh luận, với nhiều báo cáo và hàng loạt trường hợp mâu thuẫn nhau.[25-28] Nồng độ IgE tăng cao ghi nhận ở bệnh nhân viêm da cơ địa; tuy nhiên, liệu điều này có đóng một vai trò gây bệnh trong tình trạng này hay không thì vẫn chưa rõ ràng. Cho đến nay, chỉ có hai thử nghiệm ngẫu nhiên, mù đôi, đối chứng giả dược đánh giá vai trò của omalizumab trong điều trị bệnh viêm da cơ địa, nghiên cứu trên tổng số 28 bệnh nhân. [3][4] Heil và cộng sự[3] kết luận rằng omalizumab có tác dụng lâm sàng không đáng kể đối với mức độ nghiêm trọng của viêm da cơ địa, không có những thay đổi có ý nghĩa thống kê về điểm IGA hoặc EASI giữa nhóm điều trị và nhóm giả dược. Tương tự, Lyengar và cộng sự[4] không tìm thấy sự khác biệt đáng kể về kết quả lâm sàng giữa omalizumab và nhóm được điều trị bằng giả dược sau 24 tuần điều trị. Lưu ý, cả hai thử nghiệm đều có IgE huyết thanh ở mức có thể được trung hòa. Mặc dù cả hai thử nghiệm này đều xác định được những thay đổi quan trọng về phân tử và miễn dịch liên quan đến điều trị omalizumab ở bệnh nhân viêm da cơ địa, tuy nhiên cả hai đều không chứng minh được tác dụng lâm sàng tích cực của omalizumab đối với viêm da cơ địa. Điều thú vị là, một thử nghiệm ngẫu nhiên có đối chứng về ligelizumab, một chất ức chế IgE mới rất mạnh, cũng không cho thấy tác dụng lâm sàng nào ở người lớn bị viêm da cơ địa[30][31].
– Pemphigoid bọng nước
Pemphigoid bọng nước (BP) được đặc trưng bởi các tự kháng thể IgG trực tiếp chống lại các protein tạo nên hemidesmosome, gồm BP180 và BP230. Ở một bộ phận bệnh nhân BP, các tự kháng thể IgE (chống BP180) đã được xác định. Điều thú vị là, mặc dù sự hiện diện của các tự kháng thể IgE đơn thuần không tương quan với mức độ nghiêm trọng của BP, nhưng nồng độ tự kháng thể theo thời gian có tương quan với mức độ hoạt động của bệnh[32].
Bệnh nhân BP có thể có các mảng mày đay, ngứa và tăng nồng độ IgE[6][33]. Những phát hiện này cho thấy tiềm năng của liệu pháp kháng IgE trong BP. Một số trường hợp đã báo cáo về omalizumab như một phương pháp điều trị hiệu quả cho BP, với việc giảm sự hình thành bọng nước mới, giảm diện tích của các mảng mày đay, giảm ngứa và giảm nhu cầu sử dụng corticosteroid đường uống[5-8]. Có một báo cao về BP ở trẻ sơ sinh được điều trị thành công với omalizumab[34[. Thử nghiệm ngẫu nhiên có đối chứng chính thức là cần thiết để đánh giá kỹ lưỡng hơn vai trò của omalizumab trong điều trị BP.
– Dị ứng latex
Dị ứng latex là một phản ứng quá mẫn loại I qua trung gian IgE, thường thấy ở các cơ sở nghề nghiệp như nhân viên y tế. Một thử nghiệm mù đôi ngẫu nhiên, có đối chứng giả dược trên 18 nhân viên y tế bị dị ứng với latex đã chứng minh sự cải thiện trong cả thử nghiệm dị ứng kết mạc và test da khi điều trị bằng omalizumab so với giả dược[10].
– Dị ứng thức ăn
Như đã đề cập trước đây, các nghiên cứu omalizumab đã chỉ ra rằng thụ thể IgE FcεRI giảm biểu hiện tạm thời trên bạch cầu ái kiềm và tế bào mast. Mặc dù sự biểu hiện của thụ thể bạch cầu ái kiềm bị ức chế sau 1 tuần điều trị, nhưng các thụ thể của tế bào mast cần ít nhất 70 ngày để ức chế[15][18]. Các nhà nghiên cứu đang cố gắng sử dụng “sự ngắt kết nối” này để khám phá sinh lý bệnh của một số bệnh dị ứng chi tiết hơn[15]. Nghiên cứu gần đây trên bệnh nhân dị ứng lạc (đậu phộng) được điều trị bằng omalizumab cho thấy cải thiện sớm trên lâm sàng và có tương quan với sự ức chế bach cầu ái kiềm, nhưng không ức chế tế bào mast. Với những phát hiện này, nghiên cứu này đã gợi ý vai trò gây bệnh có thể có của bạch cầu ái kiềm trong dị ứng thức ăn[35]. Các phản ứng dị ứng thức ăn hiện đang được điều trị ngoài hướng dẫn bằng omalizumab. Omalizumab cũng đang được sử dụng kết hợp với liệu pháp miễn dịch đường uống. Các thử nghiệm giai đoạn I và II đang cho thấy kết quả đầy hứa hẹn, đặc biệt là 35 ở những bệnh nhân bị phản vệ do lạc[11][12] và các thử nghiệm bổ sung với omalizumab trong các trường hợp dị ứng thức ăn khác nhau đang được tiến hành[38-40].
– Khác:
+ Bệnh Kimura
+ Hội chứng tăng IgE
+ Phù mạch áp lực chậm mức độ nặng
+ Mày đay bọng nước
+ Mày đay vật lý: do ánh nắng, do lạnh
+ Phù mạch tự phát tái diễn
+ Mastocytosis
+ Hoại tử thường bì nhiễm độc
+ Mày đay viêm mạch
+ Lupus ban đỏ hệ thống
+ Phản ứng quá mẫn liên quan oxalliplatin
5. THẬN TRỌNG
– Sốc phản vệ
Omalizumab có Cảnh báo hộp đen về nguy cơ sốc phản vệ. Các triệu chứng của sốc phản vệ với omalizumab bao gồm tụt huyết áp, co thắt phế quản, phù mạch của đường thở và/hoặc da, ngất, mày đay, khó thở và ho. Tỷ lệ sốc phản vệ là 0,1% đến 0,2% (so với 0,07% trong nhóm chứng) dựa trên các thử nghiệm lâm sàng về bệnh hen[52][54]. Các thử nghiệm cho CSU không báo cáo bất kỳ trường hợp sốc phản vệ nào; tuy nhiên, gần đây có một số ít các trường hợp đã được báo cáo[54-57]. Không có trường hợp nào được báo cáo về sốc phản vệ gây tử vong do omalizumab[58][59]. Một đánh giá hồi cứu của cơ sở dữ liệu báo cáo biến cố bất lợi của FDA Hoa Kỳ đã chứng minh rằng 39% các trường hợp sốc phản vệ xảy ra sau liều omalizumab đầu tiên, 19% sau liều thứ hai, 10% sau liều thứ ba và 32% sau các liều tiếp theo. Đáng lưu ý, 24% trong số 124 bệnh nhân sốc phản vệ được báo cáo là đã có tiền sử sốc phản vệ[52]. Điều này có thể gợi ý rằng những bệnh nhân có tiền sử sốc phản vệ có nguy cơ sốc phản vệ với omalizumab cao hơn.
Thời gian khởi phát phản vệ cực kỳ khác nhau, từ vài phút đến 4 ngày sau khi dùng thuốc. Trong một nghiên cứu bệnh chứng về sốc phản vệ do omalizumab, 70% trường hợp phản vệ bắt đầu trong vòng 1 giờ sau khi dùng thuốc[58]. Có vẻ như cần thận trọng khi cung cấp cho bệnh nhân bút Epi để kiểm soát nguy cơ bị phản vệ chậm.
Cơ chế gây sốc phản vệ của omalizumab vẫn chưa được biết rõ. Kháng thể đơn dòng dựa trên chuột đã biết có một nguy cơ sốc phản vệ liên quan, tuy nhiên omalizumab chứa ít hơn 5% nguồn gốc chuột.
Những tác giả khác cho rằng thủ phạm có thể là polysorbate, một tá dược trong chế phẩm omalizumab[61]. Mặc dù sốc phản vệ là một biến chứng hiếm gặp, nhưng các bác sĩ lâm sàng phải thảo luận về các dấu hiệu và triệu chứng với tất cả bệnh nhân khi dùng omalizumab và nên tuân thủ các hướng dẫn theo dõi sau dùng thuốc được khuyến cáo.
– Bệnh ác tính
Các thử nghiệm lâm sàng ban đầu từ giai đoạn I đến III với omalizumab cho thấy tỷ lệ bệnh ác tính tăng nhẹ (0,5%) so với nhóm chứng (0,2%); tuy nhiên, các loại bệnh ác tính rất khác nhau (bao gồm ung thư tế bào hắc tố, ung thư da không tế bào hắc tố, ung thư vú, tuyến tiền liệt và tuyến mang tai) và hầu hết các bệnh nhân được theo dõi trong vòng chưa đầy 1 năm sau khi điều trị[1]. Phân tích gộp 67 thử nghiệm từ giai đoạn I đến IV với omalizumab, bao gồm 11459
bệnh nhân (7789 người trong số đó đã sử dụng omalizumab) không thấy tăng nguy cơ ác tính khi dùng omalizumab (4,14 trên 100 bệnh nhân năm) so với nhóm chứng (4,45 trên 1000 bệnh nhân-năm). Tăng thời gian sử dụng omalizumab cũng không liên quan đến việc tăng nguy cơ bệnh ác tính. Nghiên cứu này loại trừ bệnh nhân có tiền sử bệnh ác tính hoặc tiền ác tính, vì vậy tác động của omalizumab về tái phát bệnh ác tính vẫn chưa được xác định[62].
– Các nhóm đối tượng đặc biệt
+ Omalizumab có mức khuyến cáo B đối với phụ nữ mang thai. Là một kháng thể IgG, omalizumab có thể vượt qua hàng rào nhau thai. Hiện nay, không có nghiên cứu nào về omalizumab đối với phụ nữ mang thai; tuy nhiên, các nghiên cứu sinh sản ở khỉ sử dụng liều gấp 10 lần liều khuyến cáo tối đa cho người (MRHD) không cho thấy bất kỳ độc tính nào đối với mẹ, gây quái thai hoặc độc tính cho phôi thai[1]. Khỉ cũng đã sử dụng omalizumab trong khi mang thai và trong 1 tháng cho con bú. Sau 1 tháng cho con bú, nồng độ thuốc trong huyết thanh trẻ sơ sinh dao động từ 11% đến 94% nồng độ thuốc trong huyết thanh của người mẹ[17]. Xolair Pregnancy Registry (EXPECT) là hệ thống đánh giá sau khi đưa thuốc ra thị trường theo dõi những phụ nữ mang thai sử dụng omalizumab vì bệnh hen. Vào năm 2012, EXPECT đã báo cáo rằng tỷ lệ mắc các bất thường bẩm sinh lớn không khác biệt giữa omalizumab (4,4%) và dân số nói chung (2,7–4,2%) cũng như dân số chung mắc bệnh hen (2,7–9,1%)[63]. Không có nghiên cứu nào về sử dụng omalizumab cho phụ nữ đang cho con bú; tuy nhiên, IgG nội sinh được bài tiết vào sữa mẹ nên trẻ có thể tiếp xúc với omalizumab khi đang bú mẹ. Nghiên cứu ở khỉ đang cho con bú cho thấy omalizumab trong sữa ở nồng độ 1,5% so với nồng độ huyết thanh của mẹ. Vẫn chưa rõ tác dụng của sự phơi nhiễm này đối với trẻ sơ sinh[17].
+ Nghiên cứu omalizumab ở bệnh nhân lão khoa (> 65 tuổi) chỉ giới hạn ở 37 bệnh nhân CSU và 134 bệnh nhân hen. Không có đáp ứng liên quan đến tuổi được thấy trong các thử nghiệm; tuy nhiên, kích thước mẫu chưa đủ lớn để có thể hoàn toàn gợi ý các kết luận có thể xảy ra[1].
– Nhiễm ký sinh trùng
Một thử nghiệm kéo dài 1 năm trên những bệnh nhân có nguy cơ cao bị nhiễm giun sán ở Brazil cho thấy 50% (34/68) bệnh nhân sử dụng omalizumab đã ít nhất một lần nhiễm giun so với 41% (28/69) bệnh nhân sử dụng giả dược. Mặc dù mức độ nghiêm trọng của nhiễm ký sinh trùng và đáp ứng với điều trị không khác nhau giữa các nhóm, nhưng dường như có sự gia tăng nguy cơ nhiễm giun sán với omalizumab[64]. Những bệnh nhân có nguy cơ nhiễm giun cao hơn nên được theo dõi khi sử dụng omalizumab[1]. Không dữ liệu có sẵn nào về thời gian theo dõi thích hợp sau khi ngừng điều trị.
6. BIẾN CỐ BẤT LỢI
– Các thử nghiệm CSU giai đoạn III ban đầu báo cáo tỷ lệ biến cố bất lợi tương tự giữa omalizumab và nhóm chứng[54][55][57]. Đau đầu và nhiễm trùng đường hô hấp trên là biến cố bất lợi duy nhất xảy ra với omalizumab nhiều hơn nhóm chứng[55]. Lưu ý, tỷ lệ biến cố bất lợi nghiêm trọng là thấp, nhưng cao hơn một chút với liều 300 mg (6%) so với liều 150 mg và 75 mg (1%) và nhóm giả dược (3%)[54]. Một thử nghiệm điều trị dài hơn 24 tuần đã chứng minh một số biến cố bất lợi phổ biến hơn ở nhóm điều trị omalizumab (liều 150 mg hoặc 300 mg) so với giả dược. 2% hoặc lớn hơn bệnh nhân điều trị omalizumab có thể gặp các biến cố bất lợi bao gồm: đau răng, nhiễm nấm, đau cơ, đau các chi, đau cơ xương, phù ngoại vi, sốt, đau nửa đầu, đau đầu do xoang, lo lắng, đau hầu họng, hen, mày đay, và rụng tóc[1].
– Phản ứng tại vị trí tiêm.
Phản ứng tại vị trí tiêm xảy ra với tỷ lệ tương tự ở bệnh nhân được điều trị omalizumab (45%) và giả dược (43%) trong các thử nghiệm pha III. Các phản ứng thường biểu hiện trong vòng 1 giờ sau khi dùng thuốc và hết trong vòng 8 ngày. Tuy nhiên, phản ứng nghiêm trọng tại chỗ tiêm thường xảy ra với omalizumab (12%) cao hơn giả dược (9%). Tần suất phản ứng tại chỗ tiêm có xu hướng giảm khi dùng liều lặp lại[1].
– Biến cố tim mạch và mạch máu não.
Mối liên hệ có thể có giữa omalizumab và biến cố tim mạch và/hoặc mạch máu não đã được đánh giá trong một nghiên cứu thuần tập quan sát sau khi thuốc đã được lưu hành (EXCELS). Mặc dù EXCELS ban đầu được dự định để đánh giá tăng nguy cơ bệnh ác tính do omalizumab, phân tích sau đó của nghiên cứu 5 năm cho thấy tỷ lệ biến cố huyết khối-thuyên tắc động mạch (ATE) cao hơn ở nhóm omalizumab (6,66 trên 1000 người-năm) so với nhóm chứng (4,64 trên 1000 người-năm). Bệnh hen nặng phổ biến hơn ở nhóm omalizumab (50% so với 23%) có thể giải thích cho sự gia tăng này; tuy nhiên, không thể loại trừ nguy cơ gia tăng tổng thể của ATE khi sử dụng omalizumab[65]. Phân tích gộp tiếp theo của 25 thử nghiệm bao gồm hơn 6200 bệnh nhân cho thấy tỷ lệ ATE tương tự giữa các nhóm được điều trị omalizumab (2,7 trên 1000 người năm) và nhóm chứng (2,4 mỗi 1000 người-năm)[66].
7. TƯƠNG TÁC THUỐC
Không có nghiên cứu chính thức nào về các thuốc tương tác với omalizumab. Việc sử dụng corticosteroid với omalizumab cho CSU vẫn chưa được nghiên cứu.
8. THEO DÕI ĐIỀU TRỊ
Bác sĩ lâm sàng nên theo dõi bệnh nhân trong một khoảng thời gian thích hợp sau khi dùng omalizumab để phát hiện nguy cơ xuất hiện phản ứng phản vệ[1]. Không có hướng dẫn theo dõi nào khác cho omalizumab.
9. CHẾ PHẨM, LIỀU LƯỢNG
– Chế phẩm;
+ Bơm tiêm nạp sẵn liều đơn 75mg/0.5ml và 150mg/ml
+ Bột đông khô pha tiêm 150mg/lọ và 125mg/mL sau khi pha
– Đường dùng: tiêm dưới da
– Liều lượng[1]
Liều trên 150 mg cần chia ít nhất 2 vị trí tiêm để đảm bảo liều tiêm không quá 150 mg cho mỗi vị trí.
+ Hen: 75-375 mg mỗi 2-4 tuần.
+ Mày đay mạn tính tự phát: 150 hoặc 300 mg mỗi 4 tuần.
Hiện nay, omalizumab được sử dụng thường xuyên tại bệnh viện Da liễu Trung ương.
TÀI LIỆU THAM KHẢO
Bài đăng: BSNT Trịnh Ngọc Phát
Đăng bài: Phòng CTXH
Email của bạn sẽ không được hiển thị công khai. Các trường bắt buộc được đánh dấu *
.
Báo giá- Mời thầu- 1 giờ trước
Thông báo: Bệnh viện Da liễu Trung ương mời các nhà thầu quan tâm nộp hồ sơ chào giá đăng ký thực hiện dự toán mua sắm máy chuyền dịch.
Tin hoạt động- 19 giờ trước
Thông báo: Bệnh viện Da liễu Trung ương mời các nhà thầu quan tâm nộp hồ sơ chào giá đăng ký thực hiện dự toán mua sắm: Hóa chất chạy máy huyết học DXH 600..
Tin hoạt động- 1 ngày trước
Thông báo: Bệnh viện Da liễu Trung ương mời các nhà thầu quan tâm nộp hồ sơ chào giá đăng ký thực hiện dự toán mua sắm: Hóa chất IgE..
Tin hoạt động- 1 ngày trước